开云体育 开云平台开云体育 开云平台UDI通过对医疗器械产品从厂家到经销商、终端进行全渠道数据的收集、处理和分析,做到数据闭环管理和产品实时追溯,实现医疗器械产品全生命周期的追溯管理。

UDI是医疗器械唯一标识(unique device identification)的简称,是医疗器械产品的电子身份证。在医疗器械产品或者包装上附载的,由数字、字母或符号组成的代码,用于对医疗器械进行唯一性识别。可以实现医疗器械标识和各项产品数据的记录,并确认产品的生产企业、型号、规格等属性信息。
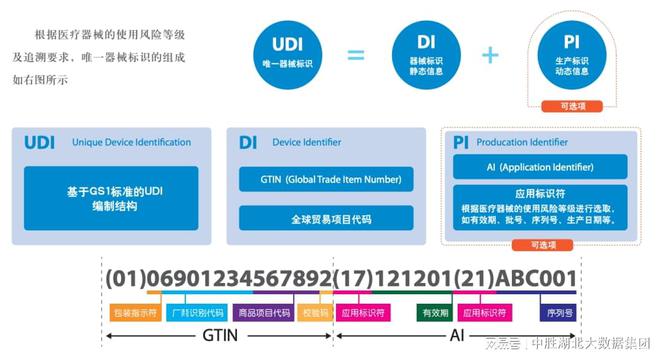
1.产品标识(DI):DI是设备的唯一识别码。这个识别码由生产商根据标准规定的编码规则生成,以确保全球范围内的唯一性。DI采用了一种叫做GS1的编码格式,它是全球通用的商品条码标准之一,因此DI可以与其他商品的条码相比较,使得不同厂家的产品也能够互相对应。
2.生产标识(PI):PI则是设备生产商的唯一标识符,它是由全球唯一的组织机构分配的代码。这个代码的作用是识别医疗器械生产过程的相关信息,如生产批号、生产日期、失效日期、序列号等。
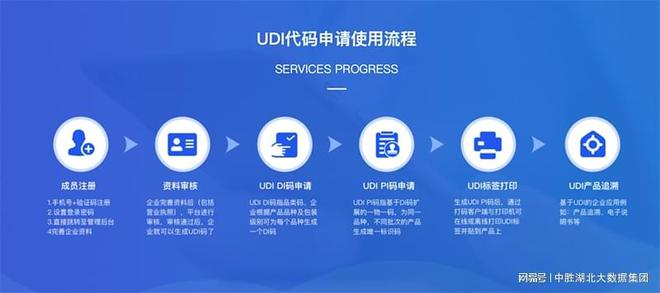
1.选择发码机构:注册人/备案人需要选择一个发码机构。在中国,认可的发码机构有三家:GS1、MA、AHM。如果企业打算将产品销往海外市场,建议选择能满足中国、欧盟和美国监管部门要求的GS1机构。
2.获取厂商识别码:注册人/备案人需要申请厂商识别码。这可以通过线上或线下方式进行。线上申请可以通过登录中国物品编码中心官网,点击“我要申请商品条码”,按照网站提示步骤操作。申请成功后,编码中心会发送手机短信。线下申请则可以前往企业注册所在地编码分支机构窗口办理。
3.编制UDI-DI:UDI-DI的组成包括包装标识符、厂商识别代码、商品项目代码和校验码。包装标识符由1位数字组成,商品项目代码由企业自行制定规则编制。
5.制作UDI标签:在完成UDI-DI和UDI-PI的编制后,下一步是生成UDI标签。这包括选择打码方式和购买打码设备。打码方式可以是单一的,也可以是组合的,但要考虑到客户方是否有对应的扫码设备。
6.完成数据库申报:注册人/备案人需要在产品上市销售前将产品标识和相关信息上传至医疗器械唯一标识数据库。此外,还需要定期更新产品标识和相关信息。
7.UDI的实施和运行:UDI的实施和运行贯穿医疗器械产品的全生命周期,需要一个强有力的项目团队来保证实施的高.效、合规、准确、稳定和可扩展性。
8.UDI码的合规使用:使用UDI码需要遵守药监局的相关规定。根据药监局平台要求,当前UDI备案仅需备案到DI产品信息,PI生产标识尚未要求备案。
9.UDI数据载体的选择:UDI的数据载体可以是一维条码、二维条码、射频标签三种类型,企业需要根据自身情况选择合适的UDI数据载体。
UDI追溯系统使生产方、经营方、使用方等产品全生命周期实现产品的自动识别、信息共享和追溯体系的建立,提高产业链透明度和出入库效率,有效降低企业运营成本。
以上是中胜大数据为大家带来的UDI的构成 UDI的申请流程的相关内容,希望对大家有所帮助!开云 开云体育平台开云 开云体育平台开云 开云体育平台

